恶性肿瘤转移往往是癌症治疗失败的主要原因。肿瘤细胞从原发部位经淋巴系统及血液系统等途径转移至其他部位形成新的转移瘤。 最新研究表明,淋巴系统中高浓度的油酸可保护黑色素瘤细胞,避免其在富含铁离子的血液中发生细胞铁死亡,促进了肿瘤转移。目前仍没有较为有效的手段抑制肿瘤的淋巴转移过程。
为了特异性诱导肿瘤细胞铁死亡,避免肿瘤转移,孙晓丹课题组基于化学动力学疗法利用生物矿化技术制备了掺杂磷酸盐的聚乙二醇修饰葡萄糖氧化酶的复合纳米材料PGC (PEG-modified GOx-CuCaP),可有效促进黑色素瘤细胞铁死亡并抑制肿瘤转移。该研究深入揭示了该纳米材料的功能机制,一方面以肿瘤微环境的弱酸性为条件,反应产生活性氧,消除抑制铁死亡的油酸分子。另一方面阻断细胞内抑制铁死亡的信号通路。进一步在动物实验中证实了该纳米材料可高效抑制肿瘤转移。该工作为治疗肿瘤淋巴转移提供了新的范例。
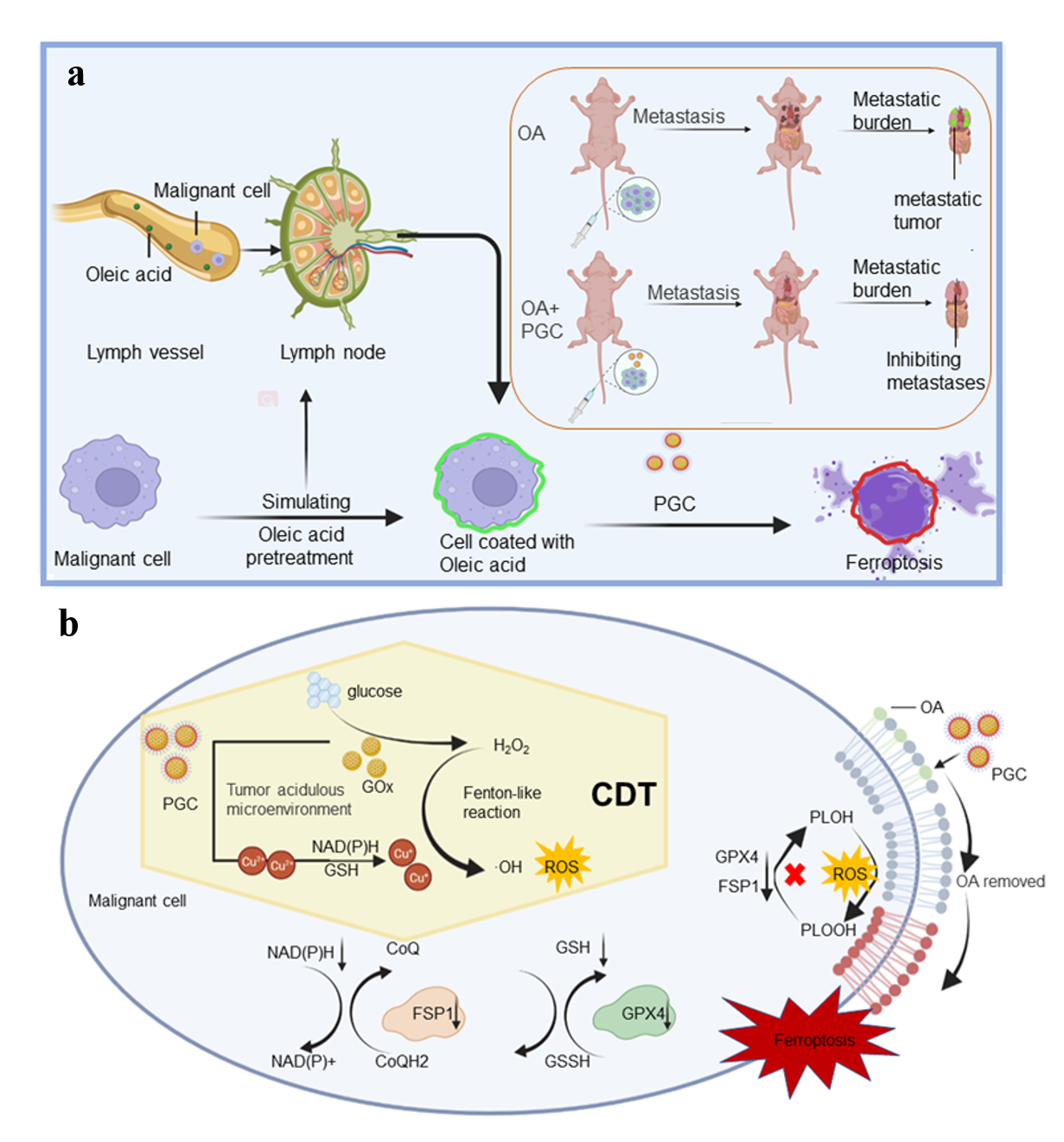
图1 PGC 作用机制示意图
随着淋巴系统中肿瘤细胞转移的铁死亡逃逸机制被阐明。迫切需要提出一种基于铁死亡逃逸机制的治疗方式来抑制淋巴系统中的恶性肿瘤转移。细胞铁死亡是一种不同于细胞凋亡,由铁离子调控的细胞膜脂质过氧化损伤而引发的程序性细胞死亡。目前为止已知的细胞内铁死亡抑制蛋白包括经典的谷胱甘肽过氧化物酶GPX4(Glutathione Peroxidase 4)以及铁死亡抑制蛋白FSP1(ferroptosis suppressor protein 1)。肿瘤微环境的弱酸性和高浓度葡萄糖可催化PGC产生活性氧,有效靶向肿瘤。根据体外细胞实验,经过PGC处理细胞后,细胞膜中油酸比例下降,为后续肿瘤细胞铁死亡提供了先决条件。蛋白免疫印迹技术和免疫组化结果显示PGC使肿瘤细胞中GPX4和FSP1蛋白水平下降,阻断了GPX4与FSP1铁死亡抑制机制,诱导细胞铁死亡。以黑色素瘤小鼠为模型,对比对照组,注射PGC后小鼠转移灶明显减少,存活率提高,证明了PGC在抑制肿瘤转移的有效性。
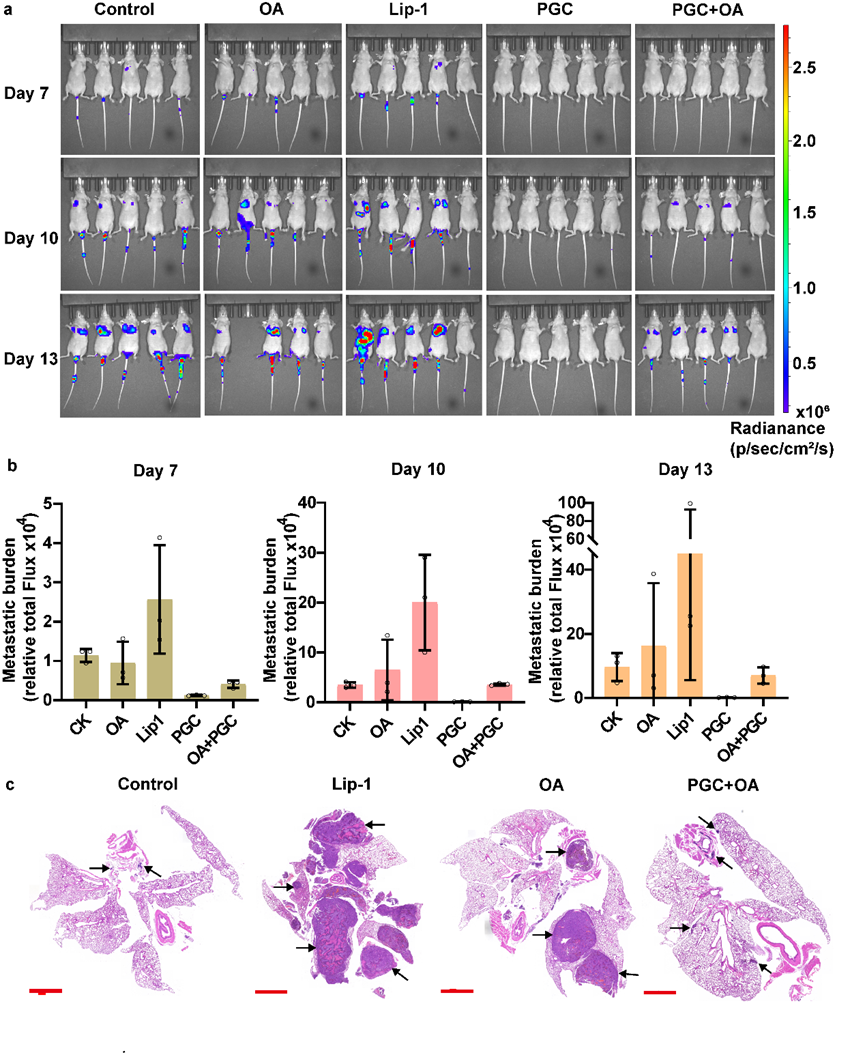
图2 动物实验显示PGC去除油酸保护抑制肿瘤转移
a) 小鼠在移植表达荧光素酶的小鼠黑色素瘤细胞后不同时间点的生物发光成像。b) 不同条件下不同时间点肿瘤组织的荧光强度。c) 不同处理下肺转移瘤的H&E染色结果。
此项工作在《今日应用材料》(applied materials today)发表了题为“通过去除铁死亡屏障的纳米工程平台用于治疗肿瘤淋巴转移”的研究论文。论文的共同第一作者是清华大学材料学院的研究助理徐囡和博士研究生江乐,清华大学材料学院的孙晓丹副研究员为该文章的通讯作者。